Entstehung von ADHS - Einführung
Autor: Ulrich Brennecke
Review: Dipl.-Psych. Waldemar Zdero
Es gibt mehrere Entstehungspfade, die allein oder gemeinsam die Entstehung von ADHS beeinflussen.
Der erste Pfad ist die genetische Veranlagung, bei der meist eine Kombination verschiedener vererbter Genvarianten zu einem Ungleichgewicht im Gehirn führt. Je nachdem, welche Abläufe im Gehirn betroffen sind, entstehen unterschiedliche ADHS-Symptome. Die genetische Veranlagung ist der häufigste Entstehungspfad von ADHS und macht etwa 76% der Ursachen aus.
Es ist eine dreistellige Anzahl monogenetische ADHS-Ursachen bekannt, bei denen die Störung eines einzigen Gens das Risiko für ADHS-Symptome relevant erhöht. Darunter sind einige, die bei deutlich mehr als 50 % der Betroffenen eine ADHS-Symptomatik auslösen. Die meisten ADHS-Kandidatengene erhöhen das Risiko jedoch nur wenig und führen nur gemeinsam mit anderen Kandidatengenen zu einer relevanten Risikoerhöhung. Dieser polygenetische Komponente erklärt etwa ein Drittel der Vererblichkeit von ADHS.1 In einer kleinen libanesischen Korrelationsstudie (n = 119) erhöhte eine familiäre Vorgeschichte von ADHS das ADHS-Risiko auf das 12-fache (OR = 12,03).2
Der zweite Entstehungspfad für ADHS ist die Umwelt. Es gibt eine Vielzahl von Umweltfaktoren, die vorgeburtlich, während der Geburt, im Kindesalter (seltener auch danach) ADHS begünstigen können. Hierunter fallen Gifte oder Medikamente, chronischer schwerer Stress sowie Krankheiten wie Enzephalitis, Schilddrüsenprobleme und viele andere.
Der dritte Pfad ist die Epigenetik, bei der Umwelteinflüsse an die Nachkommen weitervererbt werden können. Epigenetische Einflüsse verändern die Genexpression und dadurch die Menge der hergestellten Proteine, die vom Gen codiert werden. Dies kann Neurotransmitterwerte im Gehirn beeinflussen
Bei der Epigenetik werden jedoch nur die epigenetischen Veränderungen der Genexpression weitergegeben, nicht die eigentlichen Genvarianten selbst. Epigenetische Einflüsse werden daher nur über wenige Generationen weitervererbt.
Schließlich bestehen Interaktionen zwischen Genen und Umwelt, die die Entstehung von ADHS beeinflussen. Einige Genvarianten sind sensitiver für Umwelteinflüsse und können bei entsprechender Belastung oder Förderung zu einer positiven bzw. negativen Veränderung führen. Das Verhältnis von genetischen Einflüssen und Umwelteinflüssen auf ein bestehendes ADHS kann sich über die Lebenszeit verändern.
- 1. Entstehungspfade von ADHS
- 2. ADHS: Dopamin- und Noradrenalinmangel
- 3. Wie bedeutsam ist welcher Entstehungspfad von ADHS
1. Entstehungspfade von ADHS
1.1. Gene als ADHS-Ursache
1.1.1. Zusammenwirken mehrerer Genvarianten
ADHS kann durch ein zufälliges Zusammentreffen einer Summe an vererbten Genvarianten entstehen, ohne dass hierfür Umwelteinflüsse erforderlich wären. Nennen wir es “genetisch geerbtes ADHS”.
Wenn eine ausreichende Anzahl an vererbten Genvarianten in einer ähnlichen Richtung wirken, können sich ihre Einflüsse so addieren, dass in der Summe ein Ungleichgewicht im Gehirn entsteht, das nicht mehr durch die vielen sich gegenseitig ausgleichenden Regelkreisläufe des Gehirns behoben werden kann. Dann können Abläufe gestört sein. Je nachdem, welche Abläufe betroffen sind (z.B. welche Neurotransmitter in welchen Gehirnregionen erhöht oder verringert sind), entstehen unterschiedliche Störungsbilder.
Wenn mehrere Genvarianten, die jede für sich nur gering auf eine verringerte Dopamin- und Noradrenalinwirkung im Gehirn hinwirken, diese in der Summe gemeinsam zu stark verringern, können die typischen ADHS-Symptome entstehen.
Bislang sind viele hundert ADHS-relevante Gene bekannt oder verdächtigt. ⇒ Kandidatengene bei ADHS
Die genetische Verursachung ist der häufigste Entstehungspfad. Die genetische Komponente von ADHS ist mit 75 bis 80 % etwas stärker als die für Intelligenz. Diese Werte wurden allerdings im Wesentlichen durch Zwillingsstudien gewonnen, die aufgrund ähnlicher Lebensumgebungen nur eingeschränkt aussagekräftig sind.3
ADHS nimmt mit zunehmender genetischer Verwandtschaft zu:4
- eineiige Zwillinge: HR = 70,45 (70,45-faches Risiko, ADHS zu haben, im Vergleich zu eineiigen Zwillingsgeschwistern eines nicht von ADHS-Betroffenen)
- zweieiige Zwillinge: HR = 8,44 (8,45-faches Risiko im Vergleich zu zweieiigen Zwillingsgeschwistern eines nicht von ADHS-Betroffenen)
- Vollgeschwister: HR = 8,27
- Mütterliche Halbgeschwister: HR = 2,86
- Halbgeschwister väterlicherseits: HR = 2,31
- Vollcousins und -cousinen: HR = 2,24
- Halbcousins: HR = 1,47
Genstudien können bislang erst rund 20 bis 30 % der ADHS-Entstehung genetisch erklären.
Zum Vergleich ein paar andere Vererblichkeitsquoten:
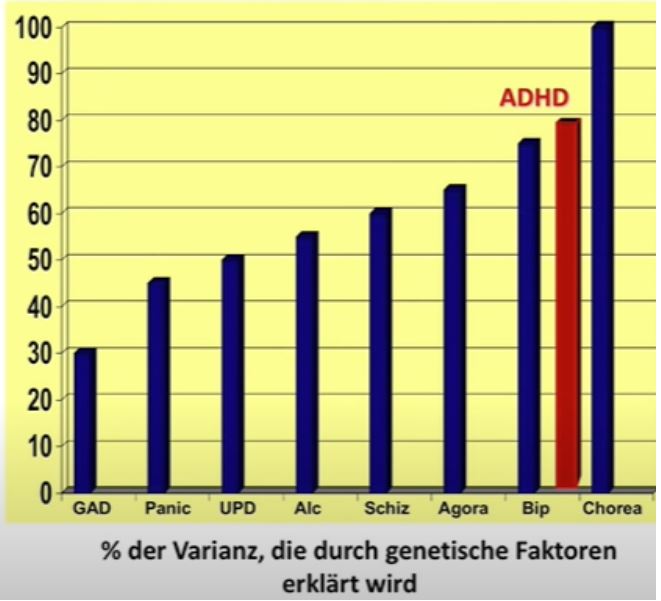
Quelle: © 2017 www.dasGehirn.info; Vortrag Andreas Reif: Fokus ADHS, Minute 14.
Generalisierte Angststörung: 30 %
Panikstörung: 45 %
Depression: 50 %
Alkoholabhängigkeit: 55 %
Schizophrenie: 60 %
Agoraphobie: 65 %
Bipolare Störung: 75 %
Chorea Huntington: 100 %
Heritabilität meint dabei den Anteil der Gene an den Ursachen des Störungsbilds, nicht aber, dass x % der Kinder von Betroffenen die jeweilige Störungsbild entwickeln.
Verwandte ersten Grades von ADHS-Betroffenen, die selbst kein ADHS haben, zeigten unter 229 Effektgrößen in mehreren Bereichen signifikant schlechtere Leistungen als Kontrollpersonen ohne ADHS, darunter: (Metastudie, k = 40)5
- Reaktionszeitvariabilität (g = 0,40)
- zeitliche Verarbeitung (g = 0,30)
- Arbeitsgedächtnis (Hedges g = 0,29)
- Verarbeitungsgeschwindigkeit (g = 0,26)
- kognitive Flexibilität (g = 0,20)
Unverändert (im Vergleich zu Kontrollen) zeigten sich
- Hemmung
- Erregung
- motorische Funktion
- Planung
- Verzögerungsaversion
Die Ergebnisse waren nur begrenzt von Geschlecht und Alter anbhängig.
1.1.2. Monogenetische Ursachen
Seltene genetisch bedingte neurologische Entwicklungsstörungen (RGNDs) betreffen bis zu 3 % der Bevölkerung. RGNDs gehen häufig mit geistiger Behinderung und psychiatrischen Komorbiditäten wie ASS und ADHS einher.6
Eine Sammlung an Genen, bei denen eine Genvariante alleine des betreffenden Gens eine sehr hohe ADHS-Prävalenz (bis über 80 % und mehr) verursacht, findet sich unter Monogenetische ADHS-Ursachen
1.2. Umwelt als ADHS-Ursache
Umweltfaktoren können zur ADHS-Entstehung beitragen. Nennen wir es “erworbenes ADHS”.
1.2.1. Früher oder chronischer starker Stress
Früher oder chronischer starker Stress kann die Expression von Genen, also ihre Aktivität, dauerhaft verändern. Dies kann die ADHS-typischen Änderungen von Neurotransmitterspiegeln auslösen bzw. die Wirkung von Neurotransmittern verändern. Die Stressmedizin beschreibt diese Mechanismen bereits für Depression. Nach diesem “Vulnerabilitäts-Stress-Modell” entstehen die meisten psychischen Störungen7: Angst, Depression, Zwang, Autismusspektrumsstörungen, Borderline-PS und viele andere.
Frühe schwere Stressoren im Sinne einer Misshandlung von Kindern setzen 45 % der Risiken psychiatrischer Störungen, die im Kindesalter beginnen.8 Schwere frühe Stressoren im Sinne einer Misshandlung von Kindern können sein:9
- Emotionaler Missbrauch
- Körperliche Misshandlung
- Sexueller Missbrauch
- Leben mit einem Drogenabhängigen
- Zusammenleben mit einem psychisch kranken Familienmitglied
- Zeuge einer gewalttätigen Behandlung der Mutter
- In Gefängnis befindliches Haushaltsmitglied
- Trennung oder Scheidung der Eltern
- Emotionale Vernachlässigung
- Physische Vernachlässigung
Betroffene, die 5 oder mehr dieser Stressoren erlebten, hatten ein stark erhöhtes Risiko der Verschreibung von Psychopharmaka:1011
- Anxiolytika: 2,1-fach
- Antidepressiva: 2,9-fach
- Antipsychotika: 10,3-fach
- Stimmungsstabilisatoren: 17,3-fach
Betroffene, die 6 oder mehr dieser Stressoren erlebten, hatten eine um 20 Jahre niedrigere Lebenserwartung.10
Frühkindliche Stresserfahrungen sind deshalb besonders bedeutsam, weil sich in den ersten Lebensjahren die Stresssysteme im Gehirn gerade erst ausbilden. Frühkindlicher Stress bewirkt dauerhafte Schädigungen der physiologischen Stresssysteme (HPA-Achse, vegetatives Nervensystem, PFC). Die zweite gefährliche Phase für ADHS ist die mittlere Jugend. ADHS-Betroffene, die in der Jugend viele schwere Stressoren erlebten, behielten ihr ADHS sehr viel häufiger im Erwachsenenalter als Kinder mit wenigen Stressoren in der Jugend.
Spezifisch für ADHS ist, dass eine breite Anzahl von Symptomen besteht, die auch für akuten oder chronischen Stress typisch (wobei sie dort funktional sind, d.h. der Bewältigung des Stressors dienen), während bei etlichen anderen psychischen Störungen einzelne Stresssymptome extrem (und dadurch dysfunktional) ausgeprägt sind.
⇒ Gendisposition plus frühkindlicher Stress als Ursache anderer psychischer Störungen ⇒ Umweltfaktoren als Ursache von ADHS
Akuter Stress erhöht u.a. den Spiegel der Neurotransmitter Dopamin,7 Noradrenalin und Serotonin7 sowie der Hormone CRH, ACTH und Cortisol. Chronischer Stress verringert Dopamin und Noradrenalin. Tritt wiederholt akut oder dauerhaft ein stressbedingt veränderter Neurotransmitter- oder Hormonspiegel in einer (früh)kindlichen Phase ein, in der die mit diesen Neurotransmittern oder Hormonen arbeitenden Gehirnsysteme gerade wachsen, werden die betreffenden Gehirnregionen in ihrer Entwicklung gestört. Gehirnregionen, die auf die oben genannten Neurotransmitter oder Hormone aufbauen, sind in ihren Wachstumsphasen daher besonders verletzlich gegen Stress. Von vielen Umweltursachen, die als Risikofaktoren für ADHS bekannt sind, weiß man, dass diese ihrerseits das Dopamin- und /oder Noradrenalinsystem angreifen.
Trifft nun eine entsprechende genetische Disposition zu einem Dopamin- / Noradrenalin(wirk)defizit mit Umweltursachen zusammen, die ihrerseits einen Dopamin- und /oder Noradrenalinmangel verursachen, wie z.B. früher oder langanhaltender Stress bei Kindern, summieren sich die Effekte und ADHS wird wahrscheinlicher, als wenn nur eine der beiden Ursachen alleine auftritt.
⇒ ADHS als chronifizierte Stressregulationsstörung
⇒ Stressschäden – Auswirkungen von frühkindlichem und/oder langanhaltendem Stress
Die Standardwerke der Stressmedizin erörtern heute, welche Gehirnbereiche sich in welchem Alter entwickeln und leiten hieraus ab, in welchem Kindesalter Stressbelastungen stattgefunden haben, weil die in dieser Zeit in Entwicklung befindlichen Gehirnregionen “fehljustiert” sind. Beispielsweise erhöht schwere Angst der Mutter während der Schwangerschaft nur in bestimmten Schwangerschaftswochen das Risiko für ADHS.
Dagegen ist Stress außerhalb der Jahre der Entwicklung des Gehirns (also ab etwa 25 Jahren) weniger gefährlich, weil er weniger irreversible Schäden verursacht – wenn auch immer noch toxisch.
Dies macht deutlich, warum ein Elternführerschein sinnvoll wäre. Nicht als Zulassungsvoraussetzung zum Kinderkriegen, sondern als Mindestwissensvermittlung darüber, was das schutzlose Wesen benötigt, das seinen Eltern anvertraut ist. Wahrscheinlich hilft das nicht allen Kindern. Doch darauf kommt es nicht an. Sicherheitsgurte schützen das Leben auch nicht bei jedem Unfall. Jedes einzelne Kind, dessen Seele dadurch vor Verletzungen bewahrt werden könnte, wäre es wert.
⇒ ADHS – Prävention und Vorsorge – Was Eltern tun können und⇒ Sichere Bindung schlägt genetische Disposition bei ADHS
1.2.2. Krankheiten
Krankheiten können ebenfalls ADHS auslösen.
Beispielsweise zerstört Enzephalitis die dopaminergen Zellen im Gehirn und kann so ein Dopamindefizit auslösen, das ADHS-typische Symptome verursacht. Da die Symptome dauerhaft bestehen, kann man Enzephalitis als eine mögliche Verursachung von ADHS betrachten. Parkinson, bei dem ebenfalls dopaminerge Zellen absterben, sowie andere Störungsbilder, bei denen das dopaminerge System in Richtung eines (Wirk-)Mangels betroffen ist, wie Schizophrenie oder ASS, haben durchgängig deutlich erhöhte ADHS-Risiken.
Weiter können Schilddrüsenprobleme Symptome auslösen, wie sie auch bei ADHS auftreten. Da diese Symptome mit einer Einstellung der Schilddrüsenhormone behebbar sind, handelt es sich hierbei nicht um ADHS. Gleiches betrifft Vitamin- oder Mineralstoffmängel, Nahrungsmittelunverträglichkeiten sowie etliche andere Störungsbilder.
⇒ Ernährung und Diät bei ADHS
Um die Ursache der Symptome festzustellen und andere Störungsursachen auszuschließen, sollte - wie bei allen Störungsbildern - auch bei der ADHS-Diagnostik eine entsprechende Differentialdiagnostik erfolgen.
⇒ Differentialdiagnostik bei ADHS
1.2.3. Immunsystem
Denkbar sind auch Krankheiten, die das Immunsystem zu ADHS-typischen Verhaltensveränderungen anregen. Hierfür bestehen jedoch nur wenige Anhaltspunkte. Wahrscheinlicher dürfte sein, dass Krankheiten dadurch zu ADHS beitragen, dass sie – genauso wie psychischer Stress – die Stresssysteme aktivieren, die die meisten ADHS-Symptome vermitteln.
⇒ Immunsystem und Verhalten
1.2.4. Weitere Umweltfaktoren
Eine Vielzahl an Untersuchungen fand eine erhebliche Menge an Umweltfaktoren, die ADHS begünstigen können, wie z.B. Gifte oder Medikamente (insbesondere während der Schwangerschaft oder in den ersten Lebensjahren), besonders junge oder bildungsferne Eltern, Wohnumgebung mit wenig Grünwuchs und etliches weiteres.
⇒ Umweltfaktoren als Ursache von ADHS
1.3. Epigenetik (Vererbte Umwelteinflüsse und Erfahrungen) als ADHS-Ursache
Durch Umwelteinflüsse erworbenes ADHS kann an die eigenen Nachfahren weitervererbt werden. Im Gegensatz zum ererbten ADHS der ersten Variante werden hier nur die epigenetischen Veränderungen der Genaktivität weitervererbt. Tierexperimente haben Vererbungen solcher erworbenen Genexpressionen über 2 bis 4 Generationen nachgewiesen. Nennen wir es “epigenetisch geerbtes ADHS”. Diese ADHS-Ursache ist im besonderen Maße einer Prävention durch fürsorgliches, warmes Elternverhalten zugänglich.
Die epigenetischen Veränderungen sind bei entsprechender Disposition leichter, bei fehlender Disposition schwerer auslösbar. Ohne genetische Disposition wird ADHS erst bei deutlich intensiverer frühkindlicher Stressbelastung (von traumatisierender Intensität: körperliche Misshandlung, psychische Misshandlung, sexueller Missbrauch) verursacht (und kann dann weitervererbt werden). Mehr hierzu unter dem Stichwort Chancen-/Risiko-Gene.
1.4. Zusammenwirken mehrerer Pfade bei der Entstehung von ADHS
Eine relevante Entstehungsvariante ist, dass zu einer bestehenden Gendisposition eine frühkindliche Stresserfahrung hinzutritt. In diesem Fall verändern sich die für ADHS verantwortlichen Gene epigenetisch so, dass sich nunmehr ADHS manifestiert (⇒ Genetische und epigenetische Ursachen von ADHS – Einführung). Epigenetik bedeutet, dass (intensive) Erfahrungen im Leben Veränderungen der Genexpression bewirken können. Diese erworbenen Veränderungen können wiederum weitervererbt werden.
2. ADHS: Dopamin- und Noradrenalinmangel
ADHS ist insbesondere von verringerten Dopamin- und Noradrenalinspiegeln in den Gehirnbereichen Striatum, PFC und Cerebellum geprägt. Während akuter Stress erhöhte Dopamin- und Noradrenalinwerte in diesen Gehirnbereichen zeigt, ist chronischer Stress ebenso wie ADHS typisch mit verringerten Dopamin- und Noradrenalinwerten in diesen Gehirnregionen assoziiert. Akuter wie chronischer Stress zeigen fast identische Symptome zu ADHS, da die Stress-/ADHS-Symptome auslösenden Funktionsstörungen der hier relevanten Gehirnregionen bei jeder Abweichung von einem mittleren Dopamin- bzw. Noradrenalin-Niveau entstehen (Inverted-U-Wirkung).
Stress hat eine besondere Bedeutung bei ADHS.
Stress ist ein Faktor, der die Entstehung von ADHS auslösen kann, wobei ein so erworbenes ADHS als Disposition vererblich ist.
Daneben werden ADHS-Symptome zu großen Teilen durch die Stresssysteme vermittelt.
ADHS macht die Betroffenen zudem stressempfindlicher.
Diese vielschichtigen Wechselwirkungen wurden von der ADHS-Fachliteratur bisher kaum berücksichtigt. Umso wichtiger ist uns eine umfassende Darstellung der Stresssysteme und ihrer Einflüsse.
⇒ Stress
Vereinzelt wird auch ein Serotoninmangel als ADHS-Ursache erörtert.12 Dies scheint uns indes nur selten tragend. SSRI zeigen nur in den seltensten Fällen eine Wirksamkeit bei ADHS. In Anbetracht der deutlich höheren Nebenwirkungen von Antidepressiva im Vergleich zu Stimulanzien sind Experimente in dieser Richtung auch wenig zielführend.
3. Wie bedeutsam ist welcher Entstehungspfad von ADHS
3.1. Genetische Komponente: ca. 76 %
ADHS hat eine starke genetische Komponente von rund 76 %. Dies wurde mit Studien an eineiigen und zweieiigen Zwillingen ermittelt.13 Die Heritabilität (Vererblichkeit) von ADHS ist damit größer als die von Intelligenz.
Diese 76 % umfassen die Gesamtheit an genetischer Vermittlung durch a. Genvarianten und b. Umwelteinflüsse bei den vorhergehenden 2 bis 4 Generationen, die durch Epigenetik weitergegeben werden. Die verbleibenden 24 % sind mithin lediglich diejenigen Umwelteinflüsse, die auf die Betroffenen selbst einwirken.
Unter den ADHS-Fällen mit klinischer Intensität seien bis zu 90 % genetisch verursacht.14 Es sind jedoch nicht einzelne Gene ursächlich, auch wenn bestimmte Genvarianten häufiger beteiligt sind. Es sind hunderte Kandidatengene bekannt. Es wäre nicht überraschend, wenn es mehr als 1000 wären. Mehr als 150 davon haben wir unter ⇒ Kandidatengene bei ADHS genannt. Dennoch können bisher nur 5 % der genetischen Heritabilität auf konkrete Genvarianten zurückgeführt werden. Dies dürfte auch daran liegen, dass Gene (bei den meisten psychischen Störungen) nur eine Disposition darstellen und noch nicht besagen, dass ADHS besteht.
Auch bei einem rein genetischen Entstehungspfad von ADHS bestehen Veränderungen der Funktionsweise der HPA-Achse (Stressachse).
⇒ Forschungsthema: ADHS im Tiermodell
Heritabilität dürfte in der Regel innerhalb 1 Generation gemessen werden. Umweltursachen können das beeinflusste Individuum, sowie über Epigenetik, 2-4 Generationen seiner Nachkommen beeinflussen. Daher gehen wir davon aus, dass der Anteil der Umweltursachen von ADHS höher liegt als 24 %. Wir schätzen ihn auf ca. 40 %.
3.2. Einfluss der Umwelt zeitabhängig
Interessanterweise verändert sich das Verhältnis des Einflusses von Genen und Umwelt auf ein bestehendes ADHS mit der Zeit.15
Bei 602 chinesischen Zwillingspaaren wurde mit 12, 13 und 15 Jahren das Maß von Hyperaktivität/Impulsivität und von Unaufmerksamkeit evaluiert.
Auf beide Symptome waren
- die genetischen Einflüsse
- waren zunächst moderat und nicht signifikant
- wurden mit der Zeit substanziell und signifikant
- die Umwelteinflüsse
- waren zunächst substantiell und signifikant
- wurden mit der Zeit moderat und nicht signifikant.
In der gesamten Jugend resultierten die Einflüsse aus
- denselben Genen und
- anderen, neu aufkommenden Umweltfaktoren
In der frühen Jugend wurde Unaufmerksamkeit überwiegend durch genetische Einflüsse, Hyperaktivität/Impulsivität vermehrt durch Umwelteinflüsse stabil gehalten.
Die genetischen Einflüsse von ADHS-HI waren tendenziell geringer, während die gemeinsamen Umwelteinflüsse in China tendenziell größer waren als in westlichen Populationen.
Mindestens etliche der bei ADHS relevanten Gene werden erst durch frühkindliche Stressbelastung epigenetisch so aktiviert, dass sie zu ADHS beitragen. Ein warmer, sicherer, fürsorglicher Bindungsstil der Eltern kann das Risiko einer epigenetischen Aktivierung von Genen und damit das ADHS-Risiko verringern. ⇒ ADHS – Prävention und Vorsorge – Was Eltern tun können
3.3. Gen-Umwelt-Interaktionen
Eine Studie fand, dass Umweltstressoren das genetische Risiko für ADHS modulieren.
Für Depressionen oder Angstsymptome fanden sich dagegen keine statistisch signifikanten Wechselwirkungen zwischen dem Polygenic Risc Score und Umwelteinflüssen.
Die Autoren empfehlen, dass insbesondere in Bezug auf Kinder mit einer familiären ADHS-Vorbelastung untersucht werden sollte, ob die Verringerung von Umweltrisiken die Entwicklung von ADHS-Symptomen verhindern kann.16
3.4. Chance-Risiko-Gene erhöhen Umwelteinfluss
Manche Gene sind nicht nur Risiko-Gene, sondern können bei entsprechender Forderung auch zu einer besonders fördernden und stärkenden Quelle werden. (Chance-Risiko-Gene, siehe ⇒ Bindungsstil der Eltern zum Kind bei Chance-/Risiko-Genen besonders wichtig)
Bestimmte Genvarianten machen ihre Träger besonders sensibel (Hochsensibilität). Dies führt zu einer besonderen Empfänglichkeit für Förderung (Chance), aber auch zum Risiko einer nochmals erhöhten Verletzlichkeit (Vulnerabilität). Bei diesen Menschen (ca. 15 %) genügt zur Aktivierung der Gendisposition von ADHS bereits eine Stressintensität deutlich unterhalb der eines Traumas: schon ein unsicherer Bindungsstil (kühl, distanziert, rein leistungsbezogen, streng, keine verlässliche Bindung etc.) kann bei der hier vorliegenden genetischen Disposition ausreichen, um ADHS epigenetisch zu manifestieren.
Ohne frühkindliche Stressbelastung und entsprechende Förderung sind hochsensible Menschen dagegen sogar noch stressresistenter als andere.
Unabhängig von einer genetischen Disposition macht Stress ganz allgemein sensibler und empfindsamer.
Die (ererbten oder durch eigene Traumata entwickelten) (Epi-)Genveränderungen vererben die Betroffenen an ihre Kinder “schlafend” weiter – Traumata sind über mehrere Generationen vererbbar. Auch bei den Kindern der Betroffenen führt wiederum erst eine Aktivierung der “schlafenden” Gendisposition zum Entstehen von ADHS.
Da die Eltern die Gene, die sie weitergeben, mit einer relevanten Wahrscheinlichkeit auch als einzelner Elternteil selbst haben, leiden die Eltern (oder ein Elternteil) häufig ebenfalls an ADHS. Die ADHS-Symptome (unbehandelter) betroffener Elternteile machen es dann hoch wahrscheinlich, dass ihre Kinder dadurch einer erhöhten Stressbelastung ausgesetzt sind und die ererbte Gendisposition so aktiviert wird.
- Genetische und epigenetische Ursachen von ADHS – Einführung
- Umweltfaktoren als Ursache von ADHS
- Immunsystem und Verhalten
- Nimmt die Häufigkeit von ADHS zu?
- ADHS – verschiedene Erklärungsmodelle früher und heute
Faraone, Larsson (2019): Genetics of attention deficit hyperactivity disorder. Mol Psychiatry. 2019 Apr;24(4):562-575. doi: 10.1038/s41380-018-0070-0. PMID: 29892054; PMCID: PMC6477889. REVIEW ↥
Assaf M, Rouphael M, Bou Sader Nehme S, Soufia M, Alameddine A, Hallit S, Landry M, Bitar T, Hleihel W (2024): Correlational Insights into Attention-Deficit/Hyperactivity Disorder in Lebanon. Int J Environ Res Public Health. 2024 Aug 5;21(8):1027. doi: 10.3390/ijerph21081027. PMID: 39200638; PMCID: PMC11353674. ↥
Joseph, J. (2015): The trouble with twin studies: A reassessment of twin research in the social and behavioral sciences. Routledge/Taylor & Francis Group. ↥
Chen Q, Brikell I, Lichtenstein P, Serlachius E, Kuja-Halkola R, Sandin S, Larsson H (2017): Familial aggregation of attention-deficit/hyperactivity disorder. J Child Psychol Psychiatry. 2017 Mar;58(3):231-239. doi: 10.1111/jcpp.12616. PMID: 27545745. n = 1.656.943 ↥
de la Paz L, Whitney BM, Weires EM, Nikolas MA (2025): A meta-analytic evaluation of cognitive endophenotypes for attention-deficit/hyperactivity disorder: Comparisons of unaffected relatives and controls. J Psychopathol Clin Sci. 2025 Apr;134(3):319-338. doi: 10.1037/abn0000985. PMID: 40029320. METASTUDY ↥
Müller AR, den Hollander B, van de Ven PM, Roes KCB, Geertjens L, Bruining H, van Karnebeek CDM, Jansen FE, de Wit MCY, Ten Hoopen LW, Rietman AB, Dierckx B, Wijburg FA, Boot E, Brands MMG, van Eeghen AM. Cannabidiol (Epidyolex®) for severe behavioral manifestations in patients with tuberous sclerosis complex, mucopolysaccharidosis type III and fragile X syndrome: protocol for a series of randomized, placebo-controlled N-of-1 trials. BMC Psychiatry. 2024 Jan 4;24(1):23. doi: 10.1186/s12888-023-05422-3. PMID: 38177999; PMCID: PMC10768432. ↥
Goldstein, Rasmusson, Bunney, Roth (1994): The NMDA glycine site antagonist (+)-HA-966 selectively regulates conditioned stress-induced metabolic activation of the mesoprefrontal cortical dopamine but not serotonin systems: a behavioral, neuroendocrine, and neurochemical study in the rat. Journal of Neuroscience 1 August 1994, 14 (8) 4937-4950; DOI: https://doi.org/10.1523/JNEUROSCI.14-08-04937.1994 ↥ ↥ ↥
Teicher, Samson (2016): Annual Research Review: Enduring neurobiological effects of childhood abuse and neglect. J Child Psychol Psychiatry. 2016 Mar;57(3):241-66. doi: 10.1111/jcpp.12507. PMID: 26831814; PMCID: PMC4760853. ↥
Felitti, Anda, Nordenberg, Williamson, Spitz, Edwards, Koss, Marks (2019): REPRINT OF: Relationship of Childhood Abuse and Household Dysfunction to Many of the Leading Causes of Death in Adults: The Adverse Childhood Experiences (ACE) Study. Am J Prev Med. 2019 Jun;56(6):774-786. doi: 10.1016/j.amepre.2019.04.001. PMID: 31104722. ↥
Brown, Anda, Tiemeier, Felitti, Edwards, Croft, Giles (2009): Adverse childhood experiences and the risk of premature mortality. Am J Prev Med. 2009 Nov;37(5):389-96. doi: 10.1016/j.amepre.2009.06.021. PMID: 19840693. ↥ ↥
Banerjee E, Nandagopal K (2015): Does serotonin deficit mediate susceptibility to ADHD? Neurochem Int. 2015 Mar;82:52-68. doi: 10.1016/j.neuint.2015.02.001. PMID: 25684070. REVIEW ↥
Faraone, Larsson (2019): Genetics of attention deficit hyperactivity disorder. Mol Psychiatry. 2019 Apr;24(4):562-575. doi: 10.1038/s41380-018-0070-0. PMID: 29892054; PMCID: PMC6477889. ↥
Barkley (2018): Vortrag an der Universität Göteborg, ca. Minute 75 ↥
Zheng, Pingault, Unger, Rijsdijk (2019): Genetic and environmental influences on attention-deficit/hyperactivity disorder symptoms in Chinese adolescents: a longitudinal twin study. Eur Child Adolesc Psychiatry. 2019 May 20. doi: 10.1007/s00787-019-01346-0. ↥
Leffa DT, Caye A, Belangero SI, Gadelha A, Pan PM, Salum GA, Rohde LA (2023): The synergistic effect of genetic and environmental factors in the development of attention-deficit/hyperactivity disorder symptoms in children and adolescents. Dev Psychopathol. 2023 Apr 24:1-11. doi: 10.1017/S0954579423000366. PMID: 37092659. ↥
