Spurenamine
Spurenamine (trace amines, TAs) sind endogene biogene Amine und eng verwandt mit biogenen Amin-Neurotransmittern.1 Sie entstehen durch Decarboxylierung von aromatischen Aminosäuren und kommen bei Wirbeltieren nur in geringen Mengen vor (Größenordnung 1/100 der korrespondierenden Neurotransmitter). Bei Wirbellosen sind sie dagegen häufig und sind dort an einem Äquivalent zum adrenergen System von Säugetieren und der Fight-and-Flight-Antwort beteiligt. Wirbellose besitzen keine TAAR.2
Spurenamine sind an der Regulation des Dopamin-, Glutamat- und Serotoninneurotransmitterstoffwechsels im Gehirn beteiligt.2
In hoher Konzentration wirken sie ähnlich wie Amphetamine an der Präsynapse auf die Freisetzung, Wiederaufnahme und Biosynthese von Katecholaminen und Indolaminen. In niedriger Konzentration zeigen sie an der Postsynapse modulierende Wirkungen, die die Aktivität anderer Neurotransmitter, insbesondere von Dopamin und Serotonin, verstärken.3
- 1. Spurenamine
- 2. Spurenamin-Rezeptoren
- 3. Abbau von Spurenaminen
- 4. Interaktion Dopaminsystem / Spurenaminsystem
- 5. Spurenamine und ADHS
1. Spurenamine
1.1. Dopamin-verwandte Spurenamine
- β-Phenylethylamin
- N-Methylphenylethylamin
- sekundäres Spurenamin
- N-Methylphenylethylamin-Derivate, die teilweise die Hirn-Blut-Schranke überwinden können, finden sich in Ginkgo biloba-Extrakten4
- p-Tyramin
- N-Methylptryramin
- sekundäres Spurenamin
- 3-Methoxytyramin
- Dopamin-Metabolit
1.2. Noradrenalin-verwandte Spurenamine
- Octopamin
- Synephrin
- sekundäres Spurenamin
1.3. Serotonin-verwandte Spurenamine
- Tryptamin
- N-Methylptryptamin
- sekundäres Spurenamin
1.4. TAAR-Agonisten
- 3-Methoxytyramin (3-MT)5
- Katecholamin-Neurotransmitter-Metabolit
- Hauptabbaustoff von Dopamin im Extrazellulärraum
- Normetanephrin6
- Katecholamin-Neurotransmitter-Metabolit
- Dimethylethylamin (DMEA)7
- Trimethylamin7
- Katecholamin-Neurotransmitter-Metabolit
- Isoamylamin8
- Katecholamin-Neurotransmitter-Metabolit
- insbesondere am mTAAR3 (Maus-TAAR-3)
- 3-Jodthyronamin (3IT)9
- ein endogener Schilddrüsenhormon-Metabolit
- Putrescin10
- Polyamin
- Kadaverin10
- Polyamin
- möglicherweise Agmatin, Spermin und Spermidin2
- N-Methylphenylethylamin1
- N-methylierten Metaboliten von PEA
- N-Methyltyramin11
- N-methylierten Metaboliten von TYR
- N,N-Dimethyltryptamin (DMT)2
- N-Methyl-Metabolit von TRP
- Dopamin
- Serotonin
1.5. Quellen von Spurenaminen
Gereifte Käsesorten, fermentiertes Fleisch, Rotwein, Sojaprodukte und Schokolade sind nachweislich mit einem oder mehreren der aromatischen Aminosäuren PEA, TYR und TRP angereichert. Meeresfrüchte zeigten hohe Spiegel von Gmatin, Kadaverin, OCT, PEA, Putrescin, Spermidin, Spermin, TRP und TYR.2 Tofu beinhaltet ebenfalls hohe Anteile aromatischer Aminosäuren.12 Aromatische Aminosäuren in Nahrungsmitteln erreichen gleichwohl kaum die Konzentration, um hTAAR zu binden, mit Ausnahme von hTAAR1 und hTAAR9 im Magen.12
- Decarboxylierung von aromatischen Aminosäuren tritt in verschiedenen Zelltypen auf, sodass Spurenamine theoretisch in diesen entstehen können:2
- Nervenzellen
- Gliazellen
- Blutgefäße
- Zellen des Magen-Darm-Trakts
- Niere
- Leber
- Lunge
- Magen
- serotonerge AADC, insbesondere im Pylorus12
Im Gehirn fanden sich in folgenden Bereichen Zellen, die mittels aromatischer L-Aminosäure-Decarboxylase (AADC) Spurenamine produzieren können:13
- Raphe-Kerne (serotonerg, sehr starke AADC)
- Pons ventral (serotonerg, sehr starke AADC)
- Medulla ventral (serotonerg, sehr starke AADC)
- Mesenzephale retikuläre Formation (dopaminerg, moderate bis starke AADC)
- Substantia nigra (dopaminerg, moderate bis starke AADC)
- VTA (domapinerg, moderate bis starke AADC)
- Locus coeruleus (noradrenerg, moderate bis starke AADC)
- Subcoeruleus-Kerne (noradrenerg, moderate bis starke AADC)
- mediane und ventrolaterale Teile des intermediären retikulären Kerns in der Medulla oblongata (noradrenerg / adrenerg, mäßige AADC)
- Vorderhirn: wenige nichtaminerge AADC-positive Neuronen (D-Neuronen); diese waren in anderen Gehirnteilen beim Menschen nicht feststellbar.
Das vom AADC-Gen kodierte Enzym aromatische L-Aminosäure-Decarboxylase tritt in unterschiedlichen Formen auf, welche die dopaminerge und die serotonerge Decarboxylase bewirken:
- Dopaminerg: 3,4-Dihydroxyphenylalanin Decarboxylase
- Serotonerg: 5-Hydroxytryptophan Decarboxylase
1.6. Regulierung der AADC
Die aromatische L-Aminosäure-Decarboxylase (AADC), mittels der Spurenamine aus Vorstoffen produziert werden, unterliegt ihrerseits regulierenden Einflüssen:
- PH-Wert-Änderungen14
- Denaturierung14
- Zerstörung dopaminerger Zellen verringerte nur die dopaminerge 3,4-Dihydroxyphenylalanin Decarboxylase, nicht die serotonerge 5-Hydroxytryptophan Decarboxylase-Aktivität, die sich dabei sogar verstärkte.15 Eine andere Studie fand dagegen, dass die Zerstörung dopaminerger ebenso wie die Zerstörung serotonerger Nervenzellen beide jeweils dopaminerge wie serotonerge AADC gleichermaßen reduzierten.16
- Die serotonerge 5-Hydroxytryptophan Decarboxylase-Aktivität und die dopaminerge 3,4-Dihydroxyphenylalanin-Dekarboxylase zeigten voneinander abweichende Aktvitätsmaxima je nach pH-Wert, Temperatur und Substratkonzentrationen:17
- Die serotonerge AADC Aktivität:
- Die dopaminerge AADC Aktivität:
1.7. Speicherung von Spurenaminen
Anders als Dopamin und Noradrenalin werden Spurenamine nicht in synaptischen Vesikeln gespeichert. Sie diffundieren aus der Nervenzelle direkt und leicht durch die Plasmamembranen.2
2. Spurenamin-Rezeptoren
Spurenamin-Rezeptoren (seit 2005: TAAR, Trace amine associated receptor) wurden in Nucleus accumbens und Substantia nigra gefunden. Es handelt sich überwiegend um G-Protein-gekoppelte Rezeptoren, die also bei Bindung an Spurenamine cAMP erhöhen.
Während andere Tiere über mehr TAAR verfügen können (Fische haben über 100), gibt es beim Menschen als hTAAR:
hTAAR sind jeweils durch eigene Gene gesteuerte funktionale Rezeptoren, bis auf hTAAR3, -4 und -7, die durch Pseudogene kodiert werden. Daneben soll es hunderte orphan hTAAR geben.12
2.1. hTAAR1 (TA-1, TAR-1, TRAR-1)
TAAR1 finden sich bei Maus wie Mensch im Gehirn am häufigsten in der Amygdala.
TAAR1 sind überwiegend intrazellulär lokalisiert, was präsynaptische und postsynaptische Wirkung ermöglicht.2
2.1.1. TAAR1-Agonisten
- Bindungsaffinität:
- Tyramin > β-Phenylethylamin > Dopamin = Octopamin19
- β-PEA > Tyramin > Tryptamin > Synephrin > Dopamin > Octopamin > Serotonin > Histamin > Noradrenalin20.
- S(+)-Amfetamin >> P-Hydroxymethamphetamin > R(−)-Amfetamine > (+)-Methamphetamin > R(−)-Apomorphin >> 1,2,3,4-Tetrahydroisoquinolin > Selegilin > d-LSD > Haloperidol > Chlorpromazin > Phencyclidin > Fluoxetin > Kokain > Pargylin, Promazin, Clozapin, Risperidon, Clorgylin20.
- Tyramin (TYR)19
- β-Phenylethylamin (PEA)19
- Dopamin (DA)21
- Octopamin (OCT)19
- Amfetamin (AMP)622
- Methylphenidat (MPH) ist kein TAAR-1-Agonist, könnte ihn aber indirekt aktivieren, indem es den Transport von Spurenaminen durch Monoamintransporter oder orphane Transporter blockiert.22
- 3,4-Methylendioxymethamfetamin (MDMA)622
- Lysergsäurediethylamid (LSD)622
- Ergolin-Derivate622
- Ractopamin23, ein Zusatzstoff in Viehfutter für Schweine, Rinder und Truthhähne in den USA (dort nicht unkritisch gesehen und zunehmend seltener verwendet); verboten in EU und Russland
- L-Isoleucin könnte ein TAAR1-Ligand sein
- Isoleucin ist eine Blut-Hirn-Schranke-gängige Aminsosäure, die besonders in Geflügel, Fleisch, Hülsenfrüchten und Käse enthalten ist.
- Phenylethanolamin scheint ein schwacher TAAR1-Ligand zu sein2
- Mephedron24
- Cathinon-Derivat
- schwacher TAAR1-Agonist
- Methylenedioxypyrovaleron24
- Cathinon-Derivat
- schwacher TAAR1-Agonist
- manche Monoamintransporter scheinen die Aktivierung von TAAR-1 zu unterstützen
- Dopamintransporter (DAT)21
- Noradrenalintransporter (NET)21
- Serotonintransporter (SERT)21
- D2-Autorezeptoren scheinen TAAR-1 zu hemmen21
- Im Körper reguliert TAAR1 die nährstoffinduzierte Hormonsekretion, was TAAR1 zu einem potenziellen therapeutischen Ziel in Bezug auf Diabetes und Fettleibigkeit macht2
- TAAR1 kann Immunreaktionen regulieren, indem es die Differenzierung und Aktivierung von Leukozyten steuert.2
Wirkung von TAAR-Agonisten.
Der selektive TAAR1-Partialagonist RO5203648 wirkt antipsychotisch, antidepressiv und etwas anxiolytisch. Er erhöhte Dopamin im VTA und Serotonin in den Raphe-Kernen. RO5203648 dämpfte Suchtverhalten und förderte deutlich Aufmerksamkeit, kognitive Leistung und Wachheit.25
Der selektive TAAR1-Agonist RO5166017 hemmte die Feuerungsfrequenz von dopaminergen Neuronen in der VTA und serotonergen Neuronen in den Raphe-Kernen. Die Feuerungsfrequenz noradrenerger Neuronen im Locus coeruleus blieb unverändert. RO5166017 veränderte die Desensibilisierungsrate und die Agonistenpotenz an 5-HT(1A)-Rezeptoren in den dorsalen Raphe-Kernen. RO5166017 verringerte durch Wirkung an TAAR1 die stressinduzierte Hyperthermie. RO5166017 verringerte die dopaminabhängige Hyperaktivität bei mit Kokain behandelten, bei DAT-KO- sowie bei mit NMDA-Antagonisten behandelten Mäusen.26
Der partielle TAAR1-Agonist RO5263397 verringerte bei Nagetieren mit chronischen Exposition gegenüber Psychostimulanzien die intravenöse Selbstverabreichung von METH.27
2.1.2. TAAR1-Antagonisten
EPPTB (N-(3-Ethoxy-phenyl)-4-pyrrolidin-1-yl-3-trifluoromethyl-benzamid)28
2.1.3. Auftreten von TAAR1
- Hypothalamus29
- präoptischer Bereich29
- VTA29
- Amygdala29
- dorsaler Raphe-Kern29
- Nucleus tractus solitarii29
- parahippocampaler Bereich (rhinale Cortices)29
- Nucleus tractus solitaire29
- Subiculum29
- nicht in
- hTAAR1 tritt (auch) im Magen und dort insbesondere im Pylorus auf12
2.1.4. TAAR1 und das dopaminerge System
Spurenamine und Dopamin zeigen komplexe Wechselwirkungen. TAAR1 regulieren Dopamin, was mit der hohen Expression von TAAR1 in VTA und Substantia nigra einhergeht.2
- Die Spurenamine β-PEA und TYR werden in dopaminergen Terminals synthetisiert, jedoch nicht in Vesikeln gespeichert. β-PEA und TYR diffundieren leicht durch Plasmamembranen.
- β-PEA- und TYR-Wiederaufnahme erfolgt über OCT2
- D2R präsynaptisch hemmt die PEA/TYR-Synthese.
- Der Abbau von Dopamin durch COMT erzeugt 3-MT (TAAR1-Agonist).
- Extrazelluläres 3-M, extrazelluläres PEA und extrazelluläres TYR sind Agonisten des TAAR1/D2R-Heteromerkomplexes präsynaptisch wie postsynaptisch.
- Dopamin scheint via TAAR1 die c-FOS-Luciferase-Expression zu induzieren, allerdings nur in Anwesenheit von DAT21
- TAAR1-Agonisten verringern die Feuerrate dopaminerger Neuronen in der VTA28
2.2. hTAAR2 (GPR58)
2.3. hTAAR3 (GPR57P)
2.4. hTAAR4 (TA2, TA2P, 5-HT4P)
2.5. hTAAR5 (PNR)
Agonisten des hTAAR5 sind:
- Dimethylethylamin (DMEA)7
- Trimethylamin (TRA)7
- Nicht am hTAAR5 binden:7
- Dimethylamin
- Methylamin
- Trimethylphosphin
- Cyclohexylamin
- N-methylpiperidin
- Pyridin
- β-Phenylethylamin
- Skatol
- Ethanolamin
- Putrescin
- Isobutylamine
- Dimethylbutylamin
2.6. hTAAR6 (TA4, TRAR4)
TAAR-630
* wird beim Menschen mit Schizophrenie und bipolarer Störung assoziiert
* nicht G-Protein-gekoppelt
* bindet nicht an Monoamine (anders als TAAR-1)
* tritt beim Rhesusaffen nicht in monoaminergen Gehirnregionen auf
2.7. hTAAR7 (TA12, TAAR7a u.a.)
Weitere frühere Bezeichnungen und Isoformen sind TA15 (TAAR7d), TA14 (TAAR7e), TA13P (TAAR7f), TA9 (TAAR 7g), TA6 (TAAR7h).2
2.8. hTAAR8 (TA5, TRAR5, TAR5, GPR102)
Weitere frühere Bezeichnungen und Isoformen sind TA11 (TAAR8a), TA7 (TAAR8b), TA10 (TAAR8c).2
2.9. hTAAR9 (TA3, TRAR3, TAR3)
3. Abbau von Spurenaminen
3.1. Wiederaufnahme
Möglicherweise wird PEA durch den OCT2-Transporter wiederaufgenommen.31
Sollte sich dies bewahrheiten, ergäbe sich hieraus ein Ansatz für medikamentöse Eingriffe.
3.1. Metabolisierung
Der Abbau von Spurenaminen erfolgt primär über MAO-A und MAO-B,32 sowie Semicarbazide-sensitive amine oxidase (SSAO; auch als Vascular adhesion protein-1 (VAP-1) Amine oxidase, copper containing 3 (AOC3) bekannt). Die Katabolisierung über Cytochrome P450 scheint möglich, aber nachrangig.2
4. Interaktion Dopaminsystem / Spurenaminsystem
Das Dopaminsystem und das TAAR1-System stehen in komplexen Wechselwirkungen:233
- TAAR1 ist ein Dopamin- und Amphetamin-Rezeptor, der mit DAT- und D2-Rezeptoren interagiert. TAAR1 spielt eine wichtige Rolle bei der Regulierung der suchtbezogenen Wirkungen von Stimulanzien34 und des dopaminergen Systems35
- TAAR1 kann nach der Heterodimerisierung mit D2R an die Zelloberfläche wandern, ein Effekt, der die D2R-Signalisierung fördert, wobei dies eher durch die Gi-Signaltransduktionskaskade als über den β-Arrestin-2-Weg erfolgt.
- Die präsynaptische D2R-Aktivierung über die Gi-Signaltransduktionskaskade führt zu einer Hemmung der PEA/TYR-Synthese.
- Dopamin wird extrazellulär durch COMT zu 3-MT abgebaut. 3-MT ist ein TAAR-1 Agonist, der wie extrazelluläres PEA und TYR den TAAR1/D2R-Heteromerkomplex sowohl an prä- als auch an postsynaptischen Membranen aktivieren kann.
- Zwischen D1R und TAAR1 bestehen keine Wechselwirkungen.
Die TAAR1-Liganden PEA und TYR zeigen indirekte sympathomimetische Wirkungen, ähnlich denen von Amphetamin,363738 z.B. Wiederaufnahmehemmung und Verdrängung von Monoamin-Neurotransmittern aus den Vesikeln. Dies tritt jedoch erst bei sehr hohen Spiegeln von mindestens 10 µM auf, (wohl das 100-fache der üblichen physiologischen Konzentrationen)333940 oder bei einer Gabe von extrem hohen Dosen von mehr als 25 mg/kg) PEA/TYR.41
Octapamin zeigt ähnliche indirekte sympathomimetische Reaktionen42
Verschiedene Amphetaminderivate binden an den TAAR1, siehe oben.
Anders als Amphetamin (und anderen Drogen) löst PEA keine konditionierte Geschmacksaversionsreaktion aus.43
Grafik aus Wikipedia: Dopamin
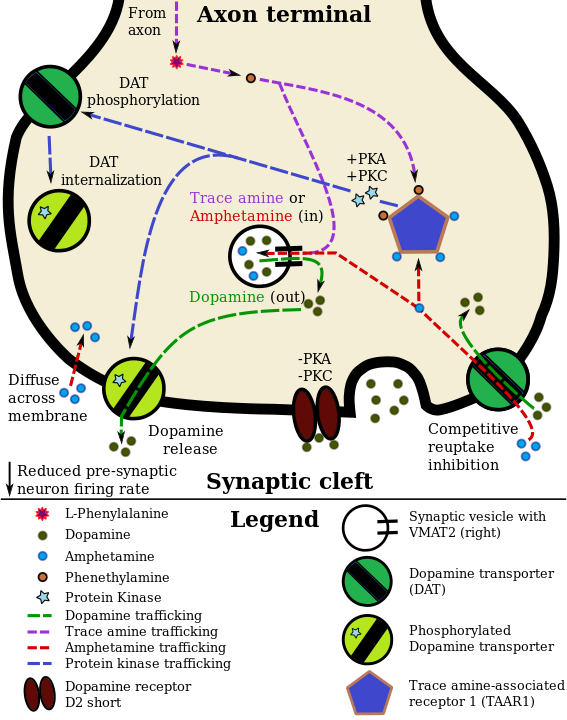
Von Seppi333 - Eigenes Werk, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=31186161
Illustration eines Dopamin-Neurons mit kolokalisiertem TAAR1-Rezeptor und den Auswirkungen eines TAAR1-Agonisten (Amphetamin oder ein Spurenamin wie Phenethylamin) auf Dopamin-Wiederaufnahme und -Efflux: Amphetamin gelangt über Membran oder DAT in das präsynaptische Neuron. Dort bindet es an TAAR1 oder gelangt via VMAT2 in die Vesikel. Bindet Amphetamin oder ein Spurenamin an TAAR1, reduziert es die Feuerrate postsynaptischer Dopamin-Neuronen (über nicht dargestellte Mechanismen) und löst die Signalübertragung durch Proteinkinase A (PKA) und Proteinkinase C (PKC) aus, was zu einer DAT-Phosphorylierung führt. Der phosphorylierte DAT schüttet dann entweder Dopamin aus (Efflux) oder zieht sich in das präsynaptische Neuron zurück und stellt den Transport ein. Wenn Amphetamin oder ein Spurenamin über VMAT2 in die synaptischen Vesikel gelangt, wird Dopamin in das Zytosol freigesetzt (hellbrauner Bereich).444546
5. Spurenamine und ADHS
Endogene Spurenamine werden seit Mitte der 1980er Jahre mit ADHS in Verbindung gebracht.
Einige Studien fanden deutlich verringerte Spiegel von β-Phenethylamin (PEA), Phenylacetylsäure (PAA), Phenylanalin und P-Tyrosin im Urin von Kindern mit ADHS oder ASS, ebenso wie PAA, Phenylanalin und Tyramin im Plasma.474849 32
MPH wie AMP normalisieren die PEA-Konzentrationen im Urin von Jungen mit ADHS.49
Eine andere kleine Studie fand erhöhte Tryptophan-Blutspiegel bei ADHS-HI, die mit Hyperaktivität korrelierten.50
Eine sehr kleine Studie fand bei ADHS:51
- 4-Pyridoxinsäure (4PA) / Tryptophan (TRP)-Verhältnis verringert
- Indoxylsulfat (IND) / Tryptophan (TRP)-Verhältnis verringert
- Indoxylsulfat (IND) / Kynurenin (KYN)-Verhältnis verringert
- TRP (Tryptophan) verdreifacht
- KYN (Kynurenin) mehr als verdoppelt
- 3-HOKYN (3-Hydroxykynurenin) mehr als verdoppelt
- 3-HOKYN ist toxisch.
- KA (Kynureninsäure) stark erhöht
- IND (Indoxylsulfat) verringert
was auf eine dramatisch beeinträchtigte Aktivität der Pyridoxin‑abhängigen Enzyme und eine angeborene Störung des B6-Stoffwechsels (wie bei Epilepsie) hinweise. Das KYN / TRP – Verhältnis stellt einen Index für die Indolamin-2,3-Dioxygenase-Aktivität dar, das den Tryptophanabbau limitierende Enzym. Das 3-HOAA/3-HOKYN-Verhältnis gilt als Index der Kynureninaseaktivität. MPH scheint bei ADHS im Plasma Kynureninsäure zu erhöhen und Chinolinsäure zu verringern. MPH veränderte den TRP-Abbau nicht, schuf jedoch eine Art Gleichgewicht zwischen einigen der nachgewiesenen Metaboliten, nicht jedoch beim 4PA/TRP-, IND/TRP- oder IND/KYN-Verhältnis. Eine Langzeitbehandlung mit Pyridoxin normalisierte die ADHS-Symptome ohne ernsthafte Nebenwirkungen.51
Eine andere Studie fand keine signifikanten Abweichungen von Tryptophan, Tyrosin oder Phenylalanine bei Kindern mit ADHS, auch wenn verringerte Blutspiegel dieser Stoffe eher mit ADHS korrelierten.52
Eine Metastudie fand bei ADHS:53
- höhere Kynureninspiegel (SMD = 0,56), auch bei medikamentennaiven Kindern mit ADHS (SMD = 0,74)
- verringerte Kynurensäurespiegel (SMD = -0,33), auch bei medikamentennaiven Kindern mit ADHS (SMD = -0,37)
- erhöhte Tryptophanspiegel bei medikamentennaiven Kindern mit ADHS (SMD = 0,31)
Lindemann, Hoener (2005): A renaissance in trace amines inspired by a novel GPCR family. Trends Pharmacol Sci. 2005 May;26(5):274-81. doi: 10.1016/j.tips.2005.03.007. PMID: 15860375. REVIEW ↥ ↥
Gainetdinov, Hoener, Berry (2018): Trace Amines and Their Receptors. Pharmacol Rev. 2018 Jul;70(3):549-620. doi: 10.1124/pr.117.015305. PMID: 29941461. REVIEW ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Burchett, Hicks (2006): The mysterious trace amines: protean neuromodulators of synaptic transmission in mammalian brain. Prog Neurobiol. 2006 Aug;79(5-6):223-46. doi: 10.1016/j.pneurobio.2006.07.003. PMID: 16962229. REVIEW ↥
Könczöl Á, Rendes K, Dékány M, Müller J, Riethmüller E, Balogh GT. Blood-brain barrier specific permeability assay reveals N-methylated tyramine derivatives in standardised leaf extracts and herbal products of Ginkgo biloba. J Pharm Biomed Anal. 2016 Nov 30;131:167-174. doi: 10.1016/j.jpba.2016.08.032. Epub 2016 Aug 29. PMID: 27592255. ↥
Sotnikova, Beaulieu, Espinoza, Masri, Zhang, Salahpour, Barak, Caron, Gainetdinov (2010): The dopamine metabolite 3-methoxytyramine is a neuromodulator. PLoS One. 2010 Oct 18;5(10):e13452. doi: 10.1371/journal.pone.0013452. Erratum in: PLoS One. 2010;5(10) doi: 10.1371/annotation/a2019934-b1cc-4781-80cb-9e09fc7ff6dc. PMID: 20976142; PMCID: PMC2956650. ↥
Bunzow, Sonders, Arttamangkul, Harrison, Zhang, Quigley, Darland, Suchland, Pasumamula, Kennedy, Olson, Magenis, Amara, Grandy (2001): Amphetamine, 3,4-methylenedioxymethamphetamine, lysergic acid diethylamide, and metabolites of the catecholamine neurotransmitters are agonists of a rat trace amine receptor. Mol Pharmacol. 2001 Dec;60(6):1181-8. doi: 10.1124/mol.60.6.1181. PMID: 11723224. ↥ ↥ ↥ ↥ ↥
[Wallrabenstein, Kuklan, Weber, Zborala, Werner, Altmüller, Becker, Schmidt, Hatt, Hummel, Gisselmann \(2013\): Human trace amine-associated receptor TAAR5 can be activated by trimethylamine. PLoS One. 2013;8\(2\):e54950. doi: 10.1371/journal.pone.0054950. PMID: 23393561; PMCID: PMC3564852.](https://pubmed.ncbi.nlm.nih.gov/12479782/) ↥ ↥ ↥ ↥ ↥
Ferrero, Wacker, Roque, Baldwin, Stevens, Liberles (2012): Agonists for 13 trace amine-associated receptors provide insight into the molecular basis of odor selectivity. ACS Chem Biol. 2012 Jul 20;7(7):1184-9. doi: 10.1021/cb300111e. Epub 2012 May 7. PMID: 22545963; PMCID: PMC3401279. ↥
Scanlan, Suchland, Hart, Chiellini, Huang, Kruzich, Frascarelli, Crossley, Bunzow, Ronca-Testoni, Lin, Hatton, Zucchi, Grandy (2004): 3-Iodothyronamine is an endogenous and rapid-acting derivative of thyroid hormone. Nat Med. 2004 Jun;10(6):638-42. doi: 10.1038/nm1051. PMID: 15146179. ↥
Hussain, Saraiva, Ferrero, Ahuja, Krishna, Liberles, Korsching (2013): High-affinity olfactory receptor for the death-associated odor cadaverine. Proc Natl Acad Sci U S A. 2013 Nov 26;110(48):19579-84. doi: 10.1073/pnas.1318596110. PMID: 24218586; PMCID: PMC3845148. ↥ ↥
(Lindemann, Hoener (2005): A renaissance in trace amines inspired by a novel GPCR family. Trends Pharmacol Sci. 2005 May;26(5):274-81. doi: 10.1016/j.tips.2005.03.007. PMID: 15860375. REVIEW ↥
Ohta, Takebe, Murakami, Takahama, Morimura (2017): Tyramine and β-phenylethylamine, from fermented food products, as agonists for the human trace amine-associated receptor 1 (hTAAR1) in the stomach. Biosci Biotechnol Biochem. 2017 May;81(5):1002-1006. doi: 10.1080/09168451.2016.1274640. PMID: 28084165. ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Kitahama K, Ikemoto K, Jouvet A, Araneda S, Nagatsu I, Raynaud B, Nishimura A, Nishi K, Niwa S. Aromatic L-amino acid decarboxylase-immunoreactive structures in human midbrain, pons, and medulla. J Chem Neuroanat. 2009 Oct;38(2):130-40. doi: 10.1016/j.jchemneu.2009.06.010. PMID: 19589383. ↥
Bender, Coulson (1972): Variations in aromatic amino acid decarboxylase activity towards DOPA and 5-hydroxytryptophan caused by pH changes and denaturation. J Neurochem. 1972 Dec;19(12):2801-10. doi: 10.1111/j.1471-4159.1972.tb03817.x. PMID: 4652630. ↥ ↥
Sims, Bloom (1973): Rat brain L-3,4-dihydroxyphenylalanine and L-5-hydroxytryptophan decarboxylase activities: differential effect of 6-hydroxydopamine. Brain Res. 1973 Jan 15;49(1):165-75. doi: 10.1016/0006-8993(73)90408-3. PMID: 4540548. ↥
Dairman, Horst, Marchelle, Bautz (1975): The proportionate loss of L-3,4-dihydroxyphenylalanine and L-5-hydroxttryptophan decarboxylating activity in rat central nervous system following intracisternal administration of 5, 6-dihydroxytryptamine or 6-hydroxydopamine. J Neurochem. 1975 Apr;24(4):619-23. PMID: 1079044. ↥
Sims, Davis, Bloom (1973): Activities of 3,4-dihydroxy-L-phenylalanine and 5-hydroxy-L-tryptophan decarboxylases in rat brain: assay characteristics and distribution. J Neurochem. 1973 Feb;20(2):449-64. doi: 10.1111/j.1471-4159.1973.tb12144.x. PMID: 4540567. ↥ ↥ ↥ ↥ ↥ ↥ ↥
ähnlich: Siow, Dakshinamurti (1985): Effect of pyridoxine deficiency on aromatic L-amino acid decarboxylase in adult rat brain. Exp Brain Res. 1985;59(3):575-81. doi: 10.1007/BF00261349. PMID: 3875501. ↥
Borowsky, Adham, Jones, Raddatz, Artymyshyn, Ogozalek, Durkin, Lakhlani, Bonini, Pathirana, Boyle, Pu, Kouranova, Lichtblau, Ochoa, Branchek, Gerald (2001): Trace amines: identification of a family of mammalian G protein-coupled receptors. Proc Natl Acad Sci U S A. 2001 Jul 31;98(16):8966-71. doi: 10.1073/pnas.151105198. PMID: 11459929; PMCID: PMC55357. ↥ ↥ ↥ ↥
Wolinsky, Swanson, Smith, Zhong, Borowsky, Seeman, Branchek, Gerald (2007): The Trace Amine 1 receptor knockout mouse: an animal model with relevance to schizophrenia. Genes Brain Behav. 2007 Oct;6(7):628-39. doi: 10.1111/j.1601-183X.2006.00292.x. PMID: 17212650. ↥ ↥
Xie, Westmoreland, Bahn, Chen, Yang, Vallender, Yao, Madras, Miller (2007): Rhesus monkey trace amine-associated receptor 1 signaling: enhancement by monoamine transporters and attenuation by the D2 autoreceptor in vitro. J Pharmacol Exp Ther. 2007 Apr;321(1):116-27. doi: 10.1124/jpet.106.116863. PMID: 17234900. ↥ ↥ ↥ ↥ ↥ ↥
Miller, Verrico, Jassen, Konar, Yang, Panas, Bahn, Johnson, Madras (2005): Primate trace amine receptor 1 modulation by the dopamine transporter. J Pharmacol Exp Ther. 2005 Jun;313(3):983-94. doi: 10.1124/jpet.105.084459. PMID: 15764732. ↥ ↥ ↥ ↥ ↥
Liu, Grandy, Janowsky (2014): Ractopamine, a livestock feed additive, is a full agonist at trace amine-associated receptor 1. J Pharmacol Exp Ther. 2014 Jul;350(1):124-9. doi: 10.1124/jpet.114.213116. PMID: 24799633; PMCID: PMC4170122. ↥
Simmler, Buchy, Chaboz, Hoener, Liechti (2016): In Vitro Characterization of Psychoactive Substances at Rat, Mouse, and Human Trace Amine-Associated Receptor 1. J Pharmacol Exp Ther. 2016 Apr;357(1):134-44. doi: 10.1124/jpet.115.229765. PMID: 26791601. ↥ ↥
Revel, Moreau, Gainetdinov, Ferragud, Velázquez-Sánchez, Sotnikova, Morairty, Harmeier, Groebke Zbinden, Norcross, Bradaia, Kilduff, Biemans, Pouzet, Caron, Canales, Wallace, Wettstein, Hoener (2012): Trace amine-associated receptor 1 partial agonism reveals novel paradigm for neuropsychiatric therapeutics. Biol Psychiatry. 2012 Dec 1;72(11):934-42. doi: 10.1016/j.biopsych.2012.05.014. PMID: 22705041. ↥
Revel, Moreau, Gainetdinov, Bradaia, Sotnikova, Mory, Durkin, Zbinden, Norcross, Meyer, Metzler, Chaboz, Ozmen, Trube, Pouzet, Bettler, Caron, Wettstein, Hoener (2011): TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity. Proc Natl Acad Sci U S A. 2011 May 17;108(20):8485-90. doi: 10.1073/pnas.1103029108. PMID: 21525407; PMCID: PMC3101002. ↥
Thorn, Jing, Qiu, Gancarz-Kausch, Galuska, Dietz, Zhang, Li (2014): Effects of the trace amine-associated receptor 1 agonist RO5263397 on abuse-related effects of cocaine in rats. Neuropsychopharmacology. 2014 Sep;39(10):2309-16. doi: 10.1038/npp.2014.91. PMID: 24743376; PMCID: PMC4138753. ↥
Bradaia, Trube, Stalder, Norcross, Ozmen, Wettstein, Pinard, Buchy, Gassmann, Hoener, Bettler (2009): The selective antagonist EPPTB reveals TAAR1-mediated regulatory mechanisms in dopaminergic neurons of the mesolimbic system. Proc Natl Acad Sci U S A. 2009 Nov 24;106(47):20081-6. doi: 10.1073/pnas.0906522106. PMID: 19892733; PMCID: PMC2785295. ↥ ↥
Lindemann, Meyer, Jeanneau, Bradaia, Ozmen, Bluethmann, Bettler, Wettstein, Borroni, Moreau, Hoener (2008): Trace amine-associated receptor 1 modulates dopaminergic activity. J Pharmacol Exp Ther. 2008 Mar;324(3):948-56. doi: 10.1124/jpet.107.132647. PMID: 18083911. ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥ ↥
Xie, Vallender, Yu, Kirstein, Yang, Bahn, Westmoreland, Miller (2008): Cloning, expression, and functional analysis of rhesus monkey trace amine-associated receptor 6: evidence for lack of monoaminergic association. J Neurosci Res. 2008 Nov 15;86(15):3435-46. doi: 10.1002/jnr.21783. PMID: 18627029; PMCID: PMC2644554. ↥
Berry, Hart, Pryor, Hunter, Gardiner (2016): Pharmacological characterization of a high-affinity p-tyramine transporter in rat brain synaptosomes. Sci Rep. 2016 Nov 30;6:38006. doi: 10.1038/srep38006. PMID: 27901065; PMCID: PMC5128819. ↥
Branchek, Blackburn (2003): Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr Opin Pharmacol. 2003 Feb;3(1):90-7. doi: 10.1016/s1471-4892(02)00028-0. PMID: 12550748. REVIEW ↥ ↥
Baker, Raiteri, Bertollini, del Carmine (1976): Interaction of beta-phenethylamine with dopamine and noradrenaline in the central nervous system of the rat. J Pharm Pharmacol. 1976 May;28(5):456-7. doi: 10.1111/j.2042-7158.1976.tb04658.x. PMID: 6762. ↥ ↥
Grandy, Miller, Li (2016): “TAARgeting Addiction”–The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference. Drug Alcohol Depend. 2016 Feb 1;159:9-16. doi: 10.1016/j.drugalcdep.2015.11.014. PMID: 26644139; PMCID: PMC4724540. ↥
Miller (2011): The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity. J Neurochem. 2011 Jan;116(2):164-76. doi: 10.1111/j.1471-4159.2010.07109.x. PMID: 21073468; PMCID: PMC3005101. ↥
Janssen, Leysen, Megens, Awouters (1999): Does phenylethylamine act as an endogenous amphetamine in some patients? Int J Neuropsychopharmacol. 1999 Sep;2(3):229-240. doi: 10.1017/S1461145799001522. PMID: 11281991. ↥
Parker, Cubeddu (1988): Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J Pharmacol Exp Ther. 1988 Apr;245(1):199-210. PMID: 3129549. ↥
Baud, Arbilla, Cantrill, Scatton, Langer (1985): Trace amines inhibit the electrically evoked release of [3H]acetylcholine from slices of rat striatum in the presence of pargyline: similarities between beta-phenylethylamine and amphetamine. J Pharmacol Exp Ther. 1985 Oct;235(1):220-9. PMID: 3930699. ↥
Raiteri, Del Carmine, Bertollini, Levi (1977): Effect of sympathomimetic amines on the synaptosomal transport of noradrenaline, dopamine and 5-hydroxytryptamine. Eur J Pharmacol. 1977 Jan 21;41(2):133-43. doi: 10.1016/0014-2999(77)90202-3. PMID: 832672. ↥
Berry (2004): Mammalian central nervous system trace amines. Pharmacologic amphetamines, physiologic neuromodulators. J Neurochem. 2004 Jul;90(2):257-71. doi: 10.1111/j.1471-4159.2004.02501.x. PMID: 15228583. ↥
Dourish (1982): An observational analysis of the behavioural effects of beta-phenylethylamine in isolated and grouped mice. Prog Neuropsychopharmacol Biol Psychiatry. 1982;6(2):143-58. doi: 10.1016/s0278-5846(82)80190-5. PMID: 7202236. ↥
Parker, Cubeddu (1988): Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J Pharmacol Exp Ther. 1988 Apr;245(1):199-210. PMID: 3129549. ↥
Greenshaw, Turrkish, Davis (2002): The enigma of conditioned taste aversion learning: stimulus properties of 2-phenylethylamine derivatives. Physiol Res. 2002;51 Suppl 1:S13-20. PMID: 12479782. ↥
Wimalasena K (2011): Vesicular monoamine transporters: structure-function, pharmacology, and medicinal chemistry. Med Res Rev. 2011 Jul;31(4):483-519. doi: 10.1002/med.20187. PMID: 20135628; PMCID: PMC3019297. REVIEW ↥
Miller GM (2011): The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity. J Neurochem. 2011 Jan;116(2):164-76. doi: 10.1111/j.1471-4159.2010.07109.x. PMID: 21073468; PMCID: PMC3005101. REVIEW ↥
Eiden LE, Weihe E (2011): VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse. Ann N Y Acad Sci. 2011 Jan;1216:86-98. doi: 10.1111/j.1749-6632.2010.05906.x. PMID: 21272013; PMCID: PMC4183197. REVIEW ↥
Kusaga (2002): [Decreased beta-phenylethylamine in urine of children with attention deficit hyperactivity disorder and autistic disorder]. No To Hattatsu. 2002 May;34(3):243-8. Japanese. PMID: 12030014. ↥
Baker, Bornstein, Rouget, Ashton, van Muyden, Coutts (1991): Phenylethylaminergic mechanisms in attention-deficit disorder. Biol Psychiatry. 1991 Jan 1;29(1):15-22. doi: 10.1016/0006-3223(91)90207-3. PMID: 2001444. ↥
Zametkin, Brown, Karoum, Rapoport, Langer, Chuang, Wyatt (1984): Urinary phenethylamine response to d-amphetamine in 12 boys with attention deficit disorder. Am J Psychiatry. 1984 Sep;141(9):1055-8. doi: 10.1176/ajp.141.9.1055. PMID: 6380319. ↥ ↥
Hoshino Y, Ohno Y, Yamamoto T, Kaneko M, Kumashiro H (1985): Plasma free tryptophan concentration in children with attention deficit disorder. Folia Psychiatr Neurol Jpn. 1985;39(4):531-5. doi: 10.1111/j.1440-1819.1985.tb00807.x. PMID: 3833631. n = 22 ↥
Dolina, Margalit, Malitsky, Rabinkov (2014): Attention-deficit hyperactivity disorder (ADHD) as a pyridoxine-dependent condition: urinary diagnostic biomarkers. Med Hypotheses. 2014 Jan;82(1):111-6. doi: 10.1016/j.mehy.2013.11.018. PMID: 24321736. n = 64 ↥ ↥
Bergwerff, Luman, Blom, Oosterlaan (2016): No Tryptophan, Tyrosine and Phenylalanine Abnormalities in Children with Attention-Deficit/Hyperactivity Disorder. PLoS One. 2016 Mar 3;11(3):e0151100. doi: 10.1371/journal.pone.0151100. PMID: 26938936; PMCID: PMC4777504. n = 155 ↥
Cavaleri D, Crocamo C, Morello P, Bartoli F, Carrà G (2024): The Kynurenine Pathway in Attention-Deficit/Hyperactivity Disorder: A Systematic Review and Meta-Analysis of Blood Concentrations of Tryptophan and Its Catabolites. J Clin Med. 2024 Jan 19;13(2):583. doi: 10.3390/jcm13020583. PMID: 38276089; PMCID: PMC10815986. ↥
